La Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) es una iniciativa de las Autoridades Reguladoras Nacionales de la Región y la Organización Panamericana de la Salud que apoya los procesos de armonización de la reglamentación farmacéutica en las Américas, en el marco de las realidades y las políticas sanitarias nacionales y subregionales y el reconocimiento de las asimetrías pre-existentes.
Avanzar en el fortalecimiento de sistemas regulatorios y de la Red PARF a través de esfuerzos de colaboración regional centrados en el acceso equitativo:
culmina la XI CPARF
Objetivos, estructura, resoluciones y estatutos
La Red Panamericana para la Armonización de la Reglamentación Farmacéutica (Red PARF) es una iniciativa de las Autoridades Reguladoras Nacionales de la Región y la Organización Panamericana de la Salud que apoya los procesos de armonización de la reglamentación farmacéutica en las Américas, en el marco de las realidades y las políticas sanitarias nacionales y subregionales y el reconocimiento de las asimetrías pre-existentes.
La Red PARF tiene los siguientes objetivos generales:
- Fortalecer las funciones y los sistemas regulatorios de los países de la Región, promoviendo la cooperación y el intercambio entre los países, con la Organización Panamericana de Salud (OPS) y con otras organizaciones regionales e internacionales, la sociedad civil, las asociaciones de la industria y la academia.
- Desarrollar, aprobar e implementar propuestas comunes (proyectos, actividades conjuntas, documentos técnicos, guías, planes de trabajo etc.) en el área de regulación de las tecnologías sanitarias, tomando en cuenta los lineamientos y estándares internacionales orientados a la convergencia regulatoria.
- Desarrollar las competencias básicas para el apoyo a la introducción y el fortalecimiento de las buenas prácticas regulatorias y el uso de las ciencias regulatorias en los Estados Miembros con el objetivo de buscar la convergencia regulatoria en la Región. Impulsar a las ARN de la Región para desarrollar y mantener organizaciones bien estructuradas para alcanzar funciones regulatorias efectivas como parte esencial de los sistemas de salud, de conformidad con las necesidades nacionales y los criterios establecidos
Miembros de la Red PARF
Los componentes de la Red PARF son: Conferencia Panamericana para la Armonización de la Reglamentación Farmacéutica (CPARF), el Comité Directivo, el Secretariado y las estructuras técnicas necesarias para la ejecución de los proyectos en las áreas estratégicas definidas.
Las conferencias, constituyen un foro continental que trata la armonización de la reglamentación farmacéutica a las que asisten todas las autoridades reguladoras de medicamentos de la región, representantes de organismos de integración económica tales como CARICOM, MERCOSUR, TLCAN, la Asociación Latinoamericana de Integración (ALADI), y la Comunidad Andina; de la industria farmacéutica; de grupos de consumidores; académicos; representantes de asociaciones regionales de profesionales; y de otros grupos interesados de todas las subregiones del continente.
La Conferencia constituye un medio para difundir las decisiones en armonización farmacéutica de iniciativas globales como la Conferencia Internacional de Autoridades Reguladoras (ICDRA, por sus siglas en inglés) y la Conferencia Internacional sobre Armonización (ICH, por sus siglas en inglés). La Red PARF ha sido nombrada miembro del Grupo Global de Cooperación de la ICH.
También facilita la integración de países del Continente que no forman parte de bloques subregionales como son los casos de Cuba, República Dominicana y Chile. Su principal objetivo es apoyar los procesos de armonización a través del análisis de aspectos específicos y la adopción de recomendaciones sobre temas prioritarios y guías armonizadas propuestas por los grupos de trabajo establecidos por la misma Conferencia. Las conclusiones y recomendaciones de la Conferencia se espera sean utilizadas por los grupos de integración económica en sus proceso de armonización y por todos los países de la Región.
El Comité Directivo es la instancia responsable por la toma de decisiones para la gestión estratégica y operativa de la Red, propiciando orientaciones para el avance de los proyectos y actividades además de hacer recomendaciones para evaluación y discusión en las Conferencias.
El Comité Directivo cuenta con un espacio de decisión reservado a la participación de los representantes de las autoridades reguladoras nacionales o iniciativas/estructuras regulatorias regionales.
El Comité Directivo contará con la participación en las discusiones, búsquedas de prioridades y temas relevantes, de representantes del Secretariado de las autoridades reguladoras nacionales además de representantes de las iniciativas/estructuras regulatorias de la Región, así como las asociaciones de productores de tecnologías sanitarias, además de FIFARMA y ALIFAR en la calidad de fundadores, según la siguiente división:
- América del Norte: Estados Unidos, Canadá y México
- América Central, Cuba y Republica Dominicana: Costa Rica, El Salvador, Guatemala, Honduras, Nicaragua, Panamá, Cuba y República Dominicana
- Caribe:Antigua y Barbuda, Bahamas, Barbados, Belice, Dominica, Granada, Guyana, Haití, Jamaica, Montserrat, San Cristóbal y Nieves, Santa Lucía, San Vicente y las Granadinas, Surinam, Trinidad y Tabago
- Región Andina: Bolivia (Estado Plurinacional), Chile, Colombia, Ecuador, Perú, Venezuela (República Bolivariana)
- Cono Sur:Argentina, Brasil, Paraguay y Uruguay
Los Miembros del Comité Directivo son nombrados por un período de cuatro años, garantizando la rotación entre los países en cada una de las Sub-Regiones con comunicación oficial al Secretariado. La rotación se da por ocasión de las Conferencias Panamericanas donde deberá haber cambio de hasta tres de los cinco miembros titulares y alternos, de acuerdo a su mayor antigüedad, a fin de preservar la continuidad de los trabajos.
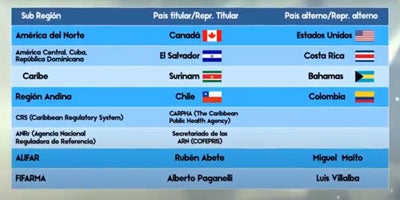
Lista de Miembros del Comité Directivo
A continuación se presenta a quienes representarán al Comité Directivo de la Red PARF hasta la realización de la X Conferencia de la Red PARF. Sus roles y atributos están descritos en los estatutos de la Red PARF.
SUBREGIÓN
América del Norte
América Central, Cuba y República Dominicana
Caribe
Región Andina
Cono Sur
PAÍS TITULAR
Estados Unidos
El Salvador
Surinam
Ecuador
Uruguay
PAÍS ALTERNO
México
Costa Rica
Bahamas
Chile
Paraguay
SUBREGIÓN
CRS
ANRr
ALIFAR*
FIFARMA*
PAÍS TITULAR
CARPHA
ANMAT
Rubén Abete
Rafael Diaz-Granados
PAÍS ALTERNO
N/A
N/A
Miguel Maito
María Fernanda Hurtado
*Miembros fundadores
El Secretariado de la Red PARF es ejercido por la Organización Panamericana de la Salud, Oficina Regional de la Organización Mundial de la Salud para las Américas, en todos sus componentes que son la Conferencia, Comité Directivo, y estructuras técnicas. Así mismo, el Secretariado prestara apoyo técnico y administrativo a la Red, entre otros puntos. Más información está disponible en los estatutos de la Red PARF.
Trabajo técnico
Los trabajos técnicos de la Red PARF apoyan la ejecución de las orientaciones y decisiones del Comité Directivo a través del desarrollo de proyectos en cada una de las áreas definidas como prioritarias por la Red.
En la VII Conferencia Panamericana de la Red PARF, ocurrida en 2013, los países aprobaron el Plan de Desarrollo Estratégico 2014-2020 donde se expresa la necesidad de elaboración de un mecanismo sistemático de establecimiento de prioridades de áreas de trabajo basado en un análisis periódico del contexto y de las necesidades de las Autoridades Reguladoras Nacionales (ARN) de los países.
El procedimiento debe ser aplicado por el Comité Directivo de la Red PARF para la definición de las áreas temáticas estratégicas bianuales, donde se implementarán los proyectos que contemplan las actividades dirigidas a lograr los objetivos finales de cada una de las áreas temáticas definidas como prioritarias. Estas áreas deben expresar funciones regulatorias o temas transversales.
Las áreas estratégicas priorizadas y aprobadas por el Comité Directivo serán preferiblemente lideradas por una ARN reconocida como de referencia regional (ARNr) bajo los criterios definidos para el mecanismo en base al dispuesto en la Resolución CD 50.R9. Cada una de estas áreas será conformada por proyectos que serán propuestos por algún de los Miembros de la Red cuya aprobación y ejecución estará a cargo de los componentes de las áreas estratégicas.
Los participantes de cada una de las áreas estratégicas priorizadas incluirán otras ARN de la región con intereses en el tema, además de representantes de las asociaciones de productores, sociedad civil y academia, según corresponda, de acuerdo al área definida. Cada uno de los proyectos aprobados dentro de las áreas priorizadas será coordinado por una de las ARN participantes de esa área. Se sugiere un promedio de nueve (9) Miembros participantes por área temática (incluyendo las ARN y los demás representantes) y la presentación de proyectos precedidos de términos de referencia presentados ante el Comité Directivo, donde constará la justificación, actividades, plazos, fuente de recursos y resultados esperados.
En base a ello, el Comité Directivo podrá monitorear el desarrollo de dichos proyectos mediante informes periódicos elaborados por los líderes de las áreas prioritarias, durante las reuniones presenciales del Comité Directivo de la Red PARF.
- Iniciativa de las Autoridades Reguladoras de Medicamentos para la evaluación conjunta de Informes periódicos de seguridad o riesgo/beneficio (IPS) y planes de gestión de riesgos (PGR). Instituto de Salud Pública de Chile (ISP). Proponen: Agencia Nacional
- Evaluación de los requisitos del CPP para procesos de registro de medicamentos en la región de las Américas hacia un acceso más oportuno a los medicamentos y enfoques regulatorios más convergentes. Iniciador: Federación Latinoamericana de la Industria Farmacéutica
- Foro Permanente de regulación de biológicos de las Américas. Poponentes: Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT -Argentina) y Health Canada (conforme al consenso alcanzado en el Taller de Regulación de Biológicos en las Américas- Buenos Aires Octubre 2016) / Respuesta a comentarios efectuados sobre el Proyecto Foro Permanente de Regulación de Biológicos de las Américas.
Consulte la información sobre PANDRH Grupos de trabajo técnicos (Hasta Diciembre 2015)
Constituyen grupos de expertos en áreas que han sido identificadas como prioritarias para la armonización farmacéutica. Sus miembros son seleccionados por el Comité Directivo y confirmados por la autoridad reguladora del país respectivo. Siempre que sea posible debe de haber representantes de cada uno de los cinco bloques subregionales de las Américas. Académicos y otros expertos pueden ser miembros de los grupos de trabajo. Sus principales objetivos incluyen los diagnósticos de situación para identificación de las diferencias entre los países en la implementación de estándares internacionales y definir las estrategias necesarias de cooperación técnica; analizar guías internacionales y preparar propuesta armonizadas en sus áreas para ser consideradas por las Conferencia para su implementación en la región.
El sistema de Grupo de Trabajo se cambió a un enfoque basado en proyectos en áreas priorizadas en 2015
Las normas y reglamentos de la Red PARF tienen un capítulo específico sobre el funcionamiento de los Grupos de Trabajo.
Los Estados Miembros promueven la armonización y la convergencia regulatoria mediante la participación en la Red PARF y en los mecanismos internacionales de armonización recomendados por la Organización Panamericana de la Salud (OPS) y la Organización Mundial de la Salud (OMS) como fuente de estándares regulatorios y buenas prácticas”.
CSP30.R12 - Política para el fortalecimiento de los sistemas regulatorios nacionales de medicamentos y otras tecnologías sanitarias
Documentos principales de la Red PARF y Resoluciones de la OPS/OMS
- Estatutos de la Red Panamericana para la Armonización de la Reglamentación Farmacéutica – Red PARF. 2015
- Términos de referencia. Procedimiento para priorización de áreas y selección de proyectos Red PARF. 2015
- Plan de desarrollo estratégico de la Red PARF 2014 - 2020
- 42.o Consejo Directivo de la Organización Panamericana de la Salud OPS/OMS. Washington, DC., del 25 al 29 de septiembre de 2000. Documento CD42/13, Rev. 1 (Esp.
- 42.o Consejo Directivo de la Organización Panamericana de la Salud OPS/OMS. Washington, DC., del 25 al 29 de septiembre de 2000. Documento Resolución CD42.R11. Armonización de la Reglamentación Farmacéutica
- 55.o Consejo Directivo. El acceso y uso racional de los medicamentos y otras tecnologías sanitarias estratégicas y de alto costo. (Resolución CD55.R12)
- CD55/10, Rev.1, - El acceso y uso racional de los medicamentos y otras tecnologías sanitarias estratégicos y de alto costo
- CD58/INF/14 - Informes de progreso sobre asuntos técnicos: Fortalecimiento de las autoridades reguladoras nacionales de medicamentos y productos biológicos: Informe de progreso
- CD59.R3 - Aumento de la capacidad de producción de medicamentos y tecnologías sanitarias esenciales
- CD59/8 - Aumento de la capacidad de producción de medicamentos y tecnologías sanitarias esenciales
Minutas y otros documentos
Documentos de las Conferencias de la Red PARF
Las conferencias, constituyen un foro continental que trata la armonización de la reglamentación farmacéutica a las que asisten todas las autoridades reguladoras de medicamentos de la región, representantes de organismos de integración económica tales como CARICOM, MERCOSUR, TLCAN, la Asociación Latinoamericana de Integración (ALADI), y la Comunidad Andina; de la industria farmacéutica; de grupos de consumidores; académicos; representantes de asociaciones regionales de profesionales; y de otros grupos interesados de todas las subregiones del continente.
- XI Conferencia: Ciudad de México, México (21 al 23 de agosto de 2024)
- X Conferencia: Sesión Extraordinaria Virtual (6, 8 y 10 de diciembre del 2022)
- IX Conferencia: San Salvador, El Salvador (24 al 26 de octubre del 2018)
- VIII Conferencia: Ciudad de México, México (19 al 21 de octubre del 2016)
- VII Conferencia: Ottawa, Canadá, (5 al 7 de septiembre de 2013)
- VI Conferencia: Brasilia, Brasil (6-8 de julio del 2011)
- V Conferencia: Buenos Aires (17-19 de noviembre del 2008)
- IV Conferencia: República Dominicana (2-4 de marzo del 2005)
- III Conferencia: Washington, D.C. (24-26 de abril del 2002)
- II Conferencia. Washington, D.C. (2-5 de noviembre del 1999)
- I Conferencia: Washington, D.C. (18-20 de noviembre del 1997)
Durante su existencia, los Grupos de Trabajo Técnicos han contribuido a la diseminación de conocimiento sobre temas congruentes con la armonización farmacéutica en la Región de las Américas. Las publicaciones que son producto de su trabajo pueden ser consultadas a continuación.
-
Objetivos, miembros, presentaciones y publicaciones de cada Grupo de Trabajo
-
Lista de los miembros de los grupos de trabajo de la Red PARF (2010)
-
Normas farmacológicas de Centroamérica y República Dominicana (NFCARD), 1999
Consulte la página web: Grupos de trabajo técnico de la Red PARF (información histórica)
En esta sección podrá encontrar un grupo de publicaciones de los grupos de trabajo de la Red Panamericana para la Armonización de la Reglamentación Farmacéutica. Algunas publicaciones son material para referencia histórica por haber sido actualizados o estar en proceso de revisión.
-
Red PARF Documento Técnico N.º 1. Requisitos armonizados para el registro de vacunas en la Región de las Américas y Guía para la preparación de una solicitud de registro sanitario. (2010) 40 p. (sólo en ingles)
-
Red PARF Documento Técnico N.º 2. (OMS) Serie de Informes Técnicos, No. 902, 2002. Informe 36, Anexo 3. Buenas prácticas para Laboratorios Nacionales de Control Farmacéutico. (2010) 137 p.
-
Red PARF Documento Técnico N.º 3. Guía de autoevaluación de buenas prácticas para Laboratorios Nacionales de Control Farmacéutico. (2010) 71 p.
-
Red PARF Documento Técnico N.º 4. Estudio sobre las condiciones actuales de los Laboratorios Oficiales de Control de Calidad de Medicamentos (LOCM) en América Latina y el Caribe. (2010) 45 p.
-
Red PARF Documento Técnico N.º 5. Buenas Prácticas de Farmacovigilancia para las Américas. (2010) 87 P. (sólo en inglés y portugués)
-
Red PARF Documento Técnico N.º 6. Documento de Autoevaluación de Buenas Prácticas de Laboratorio (BPL) (2011) 113 p.
-
Red PARF Documento Técnico N.º 7. Recomendaciones para la Evaluación de Productos Bio terapéuticos Similares (PBS) (2011) 82 p.
-
Red PARF Documento Técnico N.º 8. Marco para la Ejecución de los Requisitos de Equivalencia para los Productos Farmacéuticos (2011) 40 p. (sólo en inglés)
-
Rede PARF Documento Técnico N.º 9. Boas Práticas da OMS para Laboratórios de Controle de Qualidade de Produtos Farmacêuticos (2011) 58. (sólo en portugués)
-
Red PARF Documento Técnico N.º 10. Requisitos para el registro de medicamentos en las Américas (2013) 42 p
-
Red PARF Documento Técnico N.º 12. Criterios éticos para la promoción, propaganda y publicidad de medicamentos (2013) 16 p.
-
Red PARF Documento Técnico N.º 14. Plan de Desarrollo estratégico 2014-2020 de la Red Panamericana para la Armonización de la Reglamentación Farmacéutica